Teste de vacina de Oxford contra Covid-19 contará com 2 mil voluntários brasileiros
A partir de junho, Brasil integra projeto global para desenvolver imunização contra o novo coronavírus Sars CoV-2. Será o primeiro país fora do Reino Unido a realizar os testes
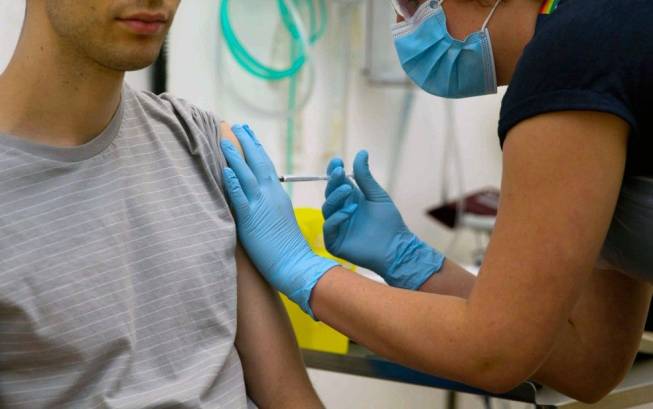
Dois mil brasileiros participarão dos testes para vacina contra a Covid-19 desenvolvida pela Universidade de Oxford. A estratégia faz parte de um plano de desenvolvimento global, e o Brasil será o primeiro país fora do Reino Unido a começar a testar a eficácia da imunização contra o Sars CoV-2.
O procedimento foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa), com o apoio do Ministério da Saúde. Em São Paulo, os testes serão feitos em mil voluntários e conduzidos pelo Centro de Referência para Imunológicos Especiais (Crie) da Universidade Federal de São Paulo (Unifesp). A Fundação Lemann está financiando a estrutura médica e os equipamentos da operação.
Os voluntários serão pessoas na linha de frente do combate ao coronavírus, com uma chance maior de exposição ao Sars CoV-2. Eles também não podem ter sido infectados em outra ocasião. Os resultados serão importantes para conhecer a segurança da vacina, prevista para final deste ano.
Testes já começaram no Reino Unido
A vacina já está sendo aplicada em 10 mil voluntários no Reino Unido. A dificuldade para provar a possível eficácia está no fato de os cientistas dependerem da continuidade da circulação do vírus entre a população para que os voluntários sejam expostos ao coronavírus Sars-Cov-2.
Doutora pelo Instituto Butantan, a cientista Daniela Ferreira coordena um dos centros que testa a vacina de Oxford e trabalha para que o esforço não seja em vão e termine arquivado nos fundos dos freezers de laboratórios.
“É uma situação um pouco bizarra, porque você quer que o coronavírus desapareça, não quer que as infecções continuem”, diz a chefe do departamento de ciências clínicas da Escola de Medicina Tropical de Liverpool.
Estágios de produção
Para chegar a uma vacina efetiva, os pesquisadores precisam percorrer diversas etapas para testar segurança e resposta imune. Primeiro há uma fase exploratória, com pesquisa e identificação de moléculas promissoras (antígenos). O segundo momento é de fase pré-clínica, em que ocorre a validação da vacina em organismos vivos, usando animais (ratos, por exemplo).
Só então é chegada à fase clínica, em humanos, dividida em quatro momentos:
Fase 1: feita em seres humanos, para verificar a segurança da vacina nestes organismos
Fase 2: onde se estabelece qual a resposta imunológica do organismo (imunogenicidade)
Fase 3: última fase de estudo, para obter o registro sanitário
Fase 4: distribuição para a população
Ferreira explicou que é apenas depois dessas fases que há o licenciamento da vacina, mas, em algumas situações, ela pode ser disponibilizada antes desse estágio para uma parcela da população.
“Durante uma pandemia, quando você não tem nenhuma outra vacina e realmente precisa de uma, é possível começar a usar vacina só com os dados da fase 3”, disse a cientista. “É possível licenciar uma vacina para o ‘uso em emergência’, que pode ser aplicada, por exemplo em médicos e enfermeiras, pessoas que estão com maior risco de exposição ao vírus, mesmo antes dessa vacina passar pela fase 4.”